- Profile
- ながもり・えいじ 1997年名古屋大学工学部生物機能工学科卒。1999年同大学院工学研究科生物機能工学専攻修士課程修了。2001年同博士課程修了。同年大阪大学大学院博士研究員。2002年豊田中央研究所研究員、グループリーダー。2011年大阪大学大学院工学研究科生命先端工学専攻生物工学コース講師。2016年から現職。博士(工学)。大阪大学在職時には澤芳樹大学院医学系研究科教授らが推進するiPS細胞由来心筋細胞シートによる心筋再生治療の開発を始めとする複数の再生医療プロジェクトにおいて細胞製造技術の構築に協力。愛知県出身。
ノーベル医学生理学賞を受賞した京都大の山中伸弥教授のiPS細胞※1は作製に成功して今年で12年。再生医療実現への大きなブレークスルーとして世界中で関連研究が巻き起こり、理化学研究所における世界初のヒト臨床試験に続き、今年5月には大阪大の心不全治療を目指した臨床研究計画が厚労省に了承され、今月からは京都大がパーキンソン病の臨床試験を開始するなど注目を集めています。再生医療の他にも、病態解析、創薬、オーダーメード治療での実用化が期待されていますが、これらを産業的に成立させるためには、数多くの工学的基盤技術の開発・実装が必要な段階と言います。大量の細胞を十分な品質(安全・機能)でタイムリーに生産し医療機関に届ける技術・産業が必要なのです。大阪工大生命工学科の長森英二准教授は、その大量培養法や骨格筋製造技術の開発なども研究。基礎研究を“バイオものづくり産業”につなげる役割を果たそうとしています。その長森准教授にiPS細胞研究の現状と産業化への課題などを聞きました。
※1【iPS細胞】「induced pluripotent stem cell」の頭文字を取った人工多能性幹細胞。人間の皮膚などの体細胞に少数(3~4つ)の因子を導入し、培養することによって作る。さまざまな組織や臓器の細胞に分化する能力とほぼ無限に増殖する能力を持つ。名付け親は、2006年に世界で初めて作製に成功しノーベル医学生理学賞を受賞した京都大の山中伸弥教授。同じ人工多能性幹細胞のES細胞が患者以外の人の受精卵を利用する倫理的な問題や拒絶反応の問題があるのと異なり、患者本人の体細胞から作られるiPS細胞にはそうした問題がなく、再生医療を一気に促進すると期待されている。
複雑な臓器の再構築へは道半ば
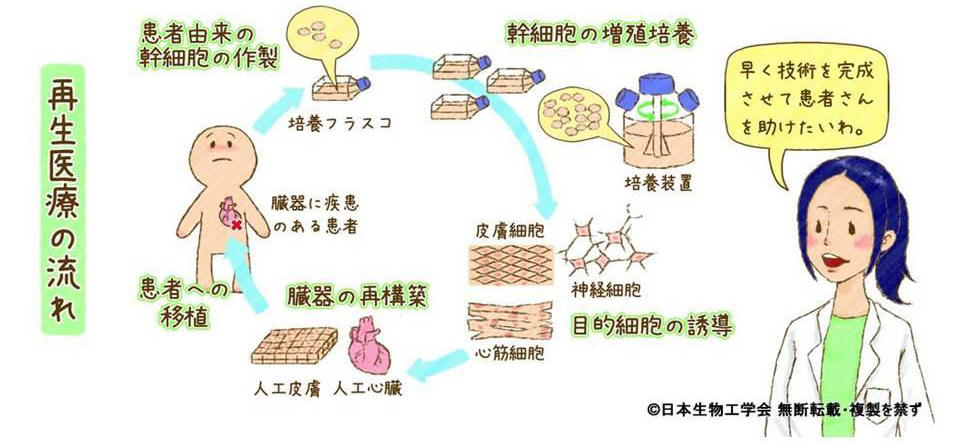
私たちの体内には未分化の幹細胞があります。状況に応じてどんな種類の細胞にも変化する万能細胞です。この万能細胞を人工的に作ったものがiPS細胞やES細胞です。iPS細胞を使った再生医療というと、臓器移植のための心臓や肝臓などを作ることをイメージする人が多いと思いますが、再生医療の現状は「まだ単純なものしかできない」段階です。心筋細胞シートや軟骨組織のような単一細胞からなり血管などを含まない構造はできるのですが、血管や神経の張り巡らされた臓器など複雑な構造の組織構築は研究途中で、まだ作ることはできません。ただ再生医療の目的は臓器を作ることだけではありません。創薬分野では単一細胞でも十分に役立ち、欧米ではこの分野が主流です。
『ひらく、ひらく「バイオの世界」─14歳からの生物工学入門』(化学同人)より転載
iPS細胞のような幹細胞から目的臓器の細胞を作り、それらを立体的に集めて目的臓器の形や機能を持たせる技術を組織工学と呼びます。医学研究者は最初の1例を作ることを誉れとしますが、それをものづくりの視点で品質を保証して、例えば1万人に提供できる技術にまでシステム化するのが工学者の役割です。
医師が使う薬を製造する製薬産業があるように、培養したiPS細胞や製造した組織・臓器を医療機関に届ける新しい“バイオものづくり産業” を育てる必要があります。この新産業が担うのは、①治療に必要な大量(10億~100億個/ 患者)のiPS細胞を必要な時に培養・製造・調達し保管する ②大量培養した細胞を材料に組織工学の技術で目的の細胞や複雑な組織・臓器を作る ③作った臓器を培養して機能的に育てる、といったことになります。
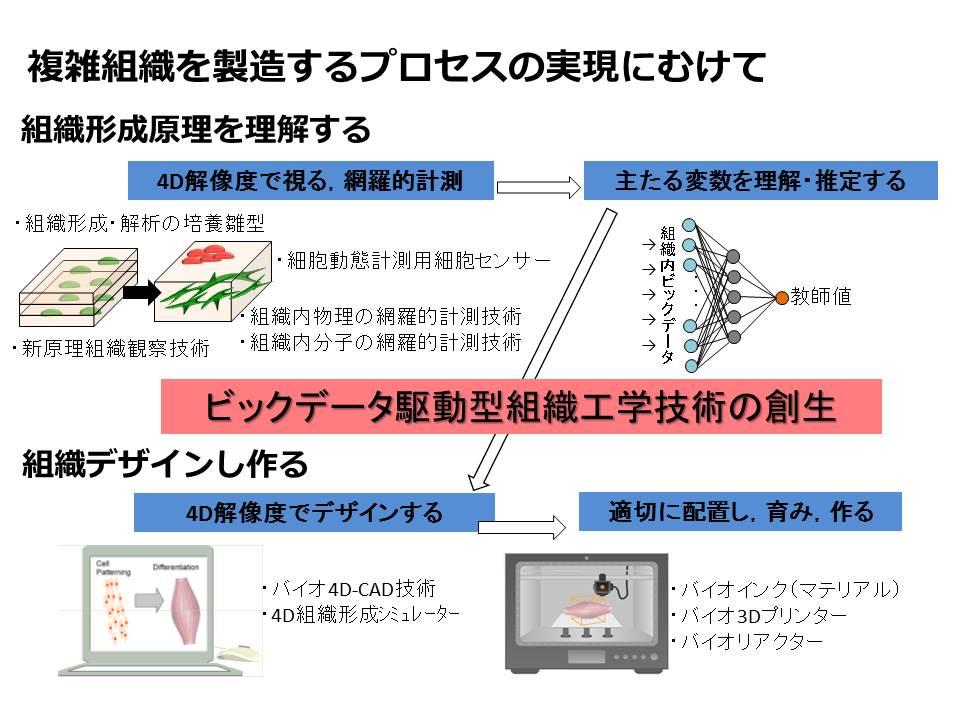
私の研究は当初、①のiPS細胞の大量培養技術の開発で、高密度な培養ができる3次元培養技術の効率化や、バイオリアクター※2で安定して培養するための装置・操作論の設計技術を開発してきました。現在では大量培養の技術はほぼ確立されてきており、私の研究も②の複雑組織の再構築に移っています。
※2【バイオリアクター】微生物などの生体触媒を用い、物質の合成・分解などを行う装置。生物反応装置。

研究室のバイオリアクター
観察し理解し設計する
組織工学は、高校の生物の教科書にも載っている受精卵が多細胞の高次な状態へ不可逆的に変化・発展する“発生” という過程をまねる技術です。発生を促進したり阻害したりするタンパク質などの因子が知られており、それらをコントロールして目的の細胞を作ります。私が力を入れている研究の一つは骨格筋という臓器を作ることです。筋肉細胞の中に血管細胞が混ざるとどんな挙動をするのか観察し理解することから始まり、血管を筋肉内に定着させ、制御し設計する技術などを研究しています。組織工学では混合した異種細胞の挙動を制御する主たる因子を特定することが難しいのです。私にとって再生医療研究の魅力は分からないものだらけの分野へのチャレンジでもあります。
作った臓器を機能的に育てるために、生体内環境を模倣した培養技術(臓器バイオリアクター)の開発も研究テーマです。例えば筋肉の場合、生体内で神経から受け取る周期的電気刺激を培養環境で再現(筋トレ培養)することで、筋組織が肥大・発達することが分かりましたし、逆に電気刺激を停止することで寝たきりなどで起こる筋委縮に似た現象を再現することにも成功しました。
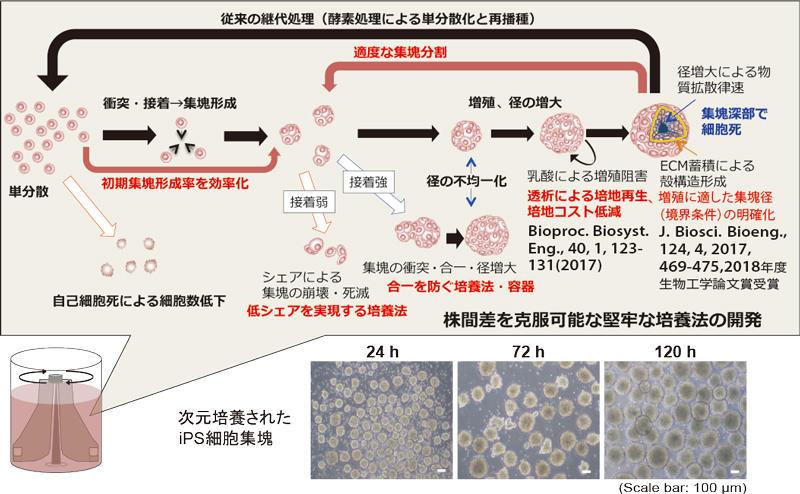
ヒトiPS細胞集塊の超大量培養技術の開発 : 増殖挙動の理解 効率的プロセス(操作)確立へ
工学的センスを持ったバイオ人材を育成
バイオと言ってもサイエンスのバイオとエンジニアリングのバイオがあります。酒造りをするのは微生物の研究者ではなく職人(技術者)です。学生を新しい産業に貢献できるバイオ技術者に育てるのも私の役目です。例えば細胞増殖を定式化できるような工学的なセンスを持って生命現象を操作できる人材を社会に送り出したいと思っています。臨床培養士などの資格認定制度も日本再生医療学会で整備されてきており、細胞培養を工学的に設計できる人材育成に対する社会からの要請は今後増します。
また、再生医療の技術は多くの要素技術を組み合わせてシステム化することが必要で、異分野研究者や企業との連携にも取り組んでいます。さしあたり骨格筋を対象に産学連携コンソーシアムの形成を進め、大阪工大をはじめ全国の研究者の知見を集めて骨格筋の再生医療、創薬支援技術はもちろん、培養食肉、培養筋アクチュエーターの実現なども視野に入れた筋機能を使いこなす技術群の社会実装(「筋スマート社会」の実現)に向けて活動しています。





 前の記事へ
前の記事へ








