- Profile
- まつお・たつひと 2005年大阪大学基礎工学部システム科学科卒。2010年同大学院基礎工学研究科機能創成専攻博士後期課程修了。高輝度光科学研究センター博士研究員、日本原子力研究開発機構研究員、量子科学技術研究開発機構主幹研究員などを経て、2024年広島国際大学保健医療学部診療放射線学科准教授。博士(理学)。大阪府出身。
長く対症療法が取られてきたアルツハイマー病にレカネマブやドナネマブといった新しい治療薬が使われるようになりました。脳内の異常なたんぱく質を取り除き、症状の悪化を抑えることを狙う薬です。患者の選択肢は増えましたが、適応の違いや副作用もあり、新たな薬剤や予防法の研究も続けられています。手掛かりの一つになるのが、たんぱく質の分子や原子の働きを明らかにすることです。広島国際大診療放射線学科の松尾龍人准教授は放射線を用いた手法でこの解明に挑んでいます。
人間の身体の中には約10万種類のたんぱく質があり、それぞれが割り当てられた固有の働きをすることで生命が維持されています。この世の全ての物質と同じく、たんぱく質も原子が集まってできています。あるたんぱく質の働きについて詳しく知ろうとすれば、原子がどのように動いているかを明らかにする必要があります。また、原子が集まって構成されている分子についても、どのような形をしているかが分かると、疾患の仕組みを明らかにすることができます。
原子や分子はとても小さく、形や動きを観察することは容易ではありません。私は、中性子線や放射光という放射線をたんぱく質に当て、放射線が散乱する角度や散乱によるエネルギー変化、たんぱく質による放射線の吸収などを測定し、理論に基づいたデータ解析を行うことで、形や動きの情報を引き出しています。
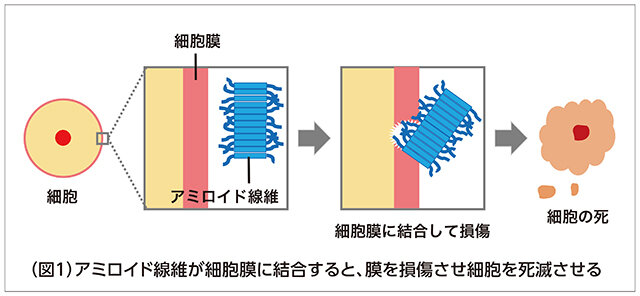
現在は主に、アミロイド線維が細胞を損傷させる仕組みを明らかにする研究に取り組んでいます。アミロイド線維とは、たんぱく質同士が何らかの原因で多数くっついて繊維状の塊になった物質です。これが体内に蓄積し、細胞の膜に結合して損傷させ、最終的には細胞を死滅させて病気になるのです(図1)。つまり、アミロイド線維は細胞にとって毒なのです。たんぱく質同士が少数くっついたオリゴマーと呼ばれる塊の毒性が高いことが古くから知られていますが、最近ではアミロイド線維自身が持つ細胞への毒性にも注目が集まっています。
アミロイド線維が原因となる疾患には、アルツハイマー病やパーキンソン病、ハンチントン病などがあります。病気ごとにアミロイド線維の元になるたんぱく質は異なります。しかし、同じたんぱく質であっても、線維を作る環境によって、形や毒性の高さに違いがあるアミロイド線維ができます。アミロイド線維の動きやすさが細胞膜への結合のしやすさに関係していることが示唆されていますが、病気の発症メカニズム解明に重要な、毒性の高いアミロイド線維は毒性の低い線維と何が違うのか、ということは分かっていません。そこで、この点を明らかにするため、①細胞への毒性の高さが異なるアミロイド線維の動き②これらのアミロイド線維が細胞膜に結合した時に起きる線維や膜の変化――について調べることにしました。
世界最先端の研究用原子炉実験施設に留学

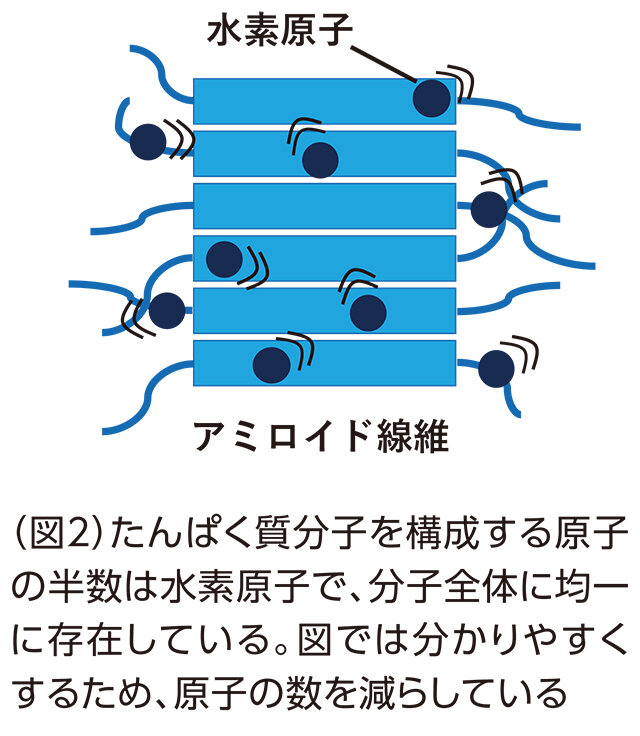
2020年3月から、フランス南東部のグルノーブルにある世界最先端の研究用原子炉実験施設「ラウエ=ランジュバン研究所(ILL)」(写真1、2)に留学したのを機に、上記の研究に着手しました。ニワトリ由来のたんぱく質を使って毒性の異なる2種類のアミロイド線維を作成。これに中性子線を当て、散乱した中性子のエネルギー変化から、アミロイド線維に含まれる水素原子の運動の大きさや速さを調べました。中性子は水素原子の運動に感度が高いこと、水素原子がたんぱく質分子を構成する原子の約半数を占め、分子全体に均一に分布していることから、たんぱく質における原子の平均的な動きを調べることができます(図2)。
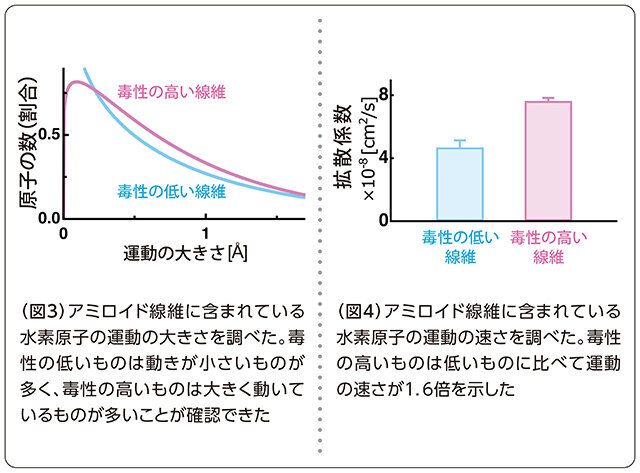
実験と解析の結果、アミロイド線維の毒性が高いものは低いものに比べて「大きく速く運動する原子」が多く存在していることを発見しました(図3)。大きくといっても原子の世界においてです。約1オングストローム(100億分の1メートル)と、水素原子の直径と同程度になります。人間の尺度からすれば非常に小さな差ですが、そのわずかな違いで毒性の高さが異なることに驚きました。また、速さについては、毒性の高いものが低いものよりも約1.6倍速く動いていることが分かりました(図4)。これらの結果から、毒性の高いアミロイド線維は大きく速く動くことによって形を変化させやすく、細胞膜に結合しやすい形を素早く取ることができると考えられます。
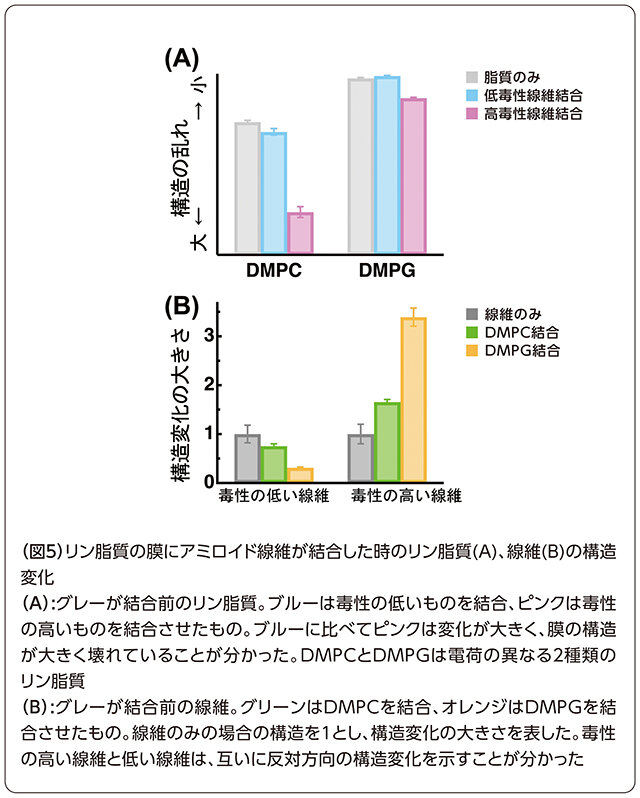
次に、アミロイド線維が細胞膜に結合した時に、膜と線維それぞれに起きる構造変化についても調べました。本物の細胞膜の代わりに、細胞膜の構成成分であるリン脂質を2種類用意して、それぞれに前述の毒性の異なる2種類のアミロイド線維を結合させました。そして、研究室にある分光蛍光光度計を用いた蛍光測定と、広島大放射光科学研究所の放射光を用いた吸収測定を行いました。その結果、毒性の高いアミロイド線維が結合した膜は、低いものが結合した時に比べて構造が大きく壊れていることが分かりました(図5A)。また、アミロイド線維自体にも線維内部で構造変化が起きていることが分かり、毒性の高さの違いによって構造変化の傾向が逆になることも明らかになりました(図5B)。このように、高い毒性を持つアミロイド線維に特有の性質が分子・原子のレベルで少しずつ分かってきています。
放射線を使った実験の難しさは、入念な計画が求められることです。一般的には年に2回、実験案を提出し、審査を受けます。採択されれば「ビームタイム」という放射線を利用できる時間が割り当てられるので、その時に合わせて試料の準備をしなければなりません。やり直しがきかないため、細心の注意が必要です。また、実験の測定データを見て、すぐに何かが分かるということはありません。理論に基づき、プログラミングを併用して、少しずつ読み解いていく必要があります。時間はかかりますが、まだ世界の誰も知らない結果が得られるので、難しくもここが一番面白いところです。
これまでの実験では、比較的安価で大量に入手できるモデルたんぱく質やリン脂質を使って、放射線を利用した実験に適した試料の取り扱いや解析のノウハウを蓄積することができました。今後は、これらのノウハウを生かして、アルツハイマー病などアミロイド線維が関係する疾患の原因たんぱく質を使って研究を進めていきたいと考えています。究極的には、患者組織から抽出したアミロイド線維やヒトの神経細胞膜を使った研究を展開し、重症化につながるアミロイド線維やリン脂質分子の特徴を原子レベルで解明したいと思っています。これらの研究により、アミロイド線維や脂質分子を構成する原子の運動の仕方を変えることで、毒性を和らげるような薬剤分子の探索へと発展させる可能性があると考えています
今回のNewWAVEで紹介した松尾准教授の研究に関する論文は以下の通り。
・Matsuo et al., Front. Mol. Biosci. 8:812096 (2022). DOI: 10.3389/fmolb.2021.812096
・Matsuo et al., Phys. Chem. Chem. Phys. 26:18943-18952 (2024). DOI: 10.1039/D4CP00965G

俯瞰的な視点持つ大切さを伝えたい
私は、本学の診療放射線学科の授業では、自分の研究分野に近いものについて最新の知見を紹介するなど、可能な限り新しい情報を学生に提供しています。大学で学ぶ内容は高校までのように全て確立されているものではなく、現在世界中で進められている研究によってダイナミックに変化し得るものだということも理解してもらえるように心掛けています。自然現象の原理を追究する研究は一般的に、すぐに私たちの生活に役立つ成果が得られるわけではありません。しかし、時間をかけて成果を蓄積することが新しい技術へとつながり、私たちの生活にも影響を与えるようになることから、どのような研究に対しても「何の役に立つのか」という短期的な実利を求めるのではなく、より俯瞰的な視点を持つことが大切だということも伝わるように努めています。







 前の記事へ
前の記事へ








